| □ Top |
| □ Members |
| □ Research |
| □ Publication |
| □ Equipments |
| □ Information |
| □ Links |
| □ Photo |
Research
自然界から発見される生理活性物質の中には優れた医薬品,香料として期待されているものがありますが,多くは複雑な構造のため,今なお化学合成による供給が極めて困難な状況にあります。この問題を解決するためにこれまでにない合成反応の開発が求められており,本研究室では環境に配慮した固相反応,光反応などを利用する合成法や新しい有機金属触媒を用いた合成法の開発を行っています。
●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●
最近の研究テーマから
◆結晶のキラリティーを利用した絶対不斉合成法の開発
◆炭素-窒素結合間に軸不斉を持つ不斉配位子の開発
◆ヒドラゾン-遷移金属触媒を用いた結合形成反応の開発
◆有機分子触媒を用いる極性転換反応による新規不斉合成法開発
◆キラル超原子価ハロゲン化合物の開発と応用
●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●○●
◆結晶のキラリティーを利用した絶対不斉合成法の開発
この研究は生命の起源説にも深く関連しているテーマです。プロキラルな化合物やラセミ体混合物が結晶化することにより自然に発現する結晶のキラリティーだけを不斉源とし,他の外的な不斉源を全く用いずに,不斉合成を達成してしまう手法です。これを実現する以下の4つの手法を開発しています。最近は,特に4のテーマについて精力的に研究しています。
1.プロキラル化合物のキラル結晶を利用した固相光反応による絶対不斉合成
2.キラル結晶から誘導したフローズンキラリティーを利用した絶対不斉合成
3.コングロメレート結晶を利用したラセミ体の動的優先晶出法による完全光学分割
4.可逆反応と動的結晶化を融合した新しい絶対不斉合成法の開発
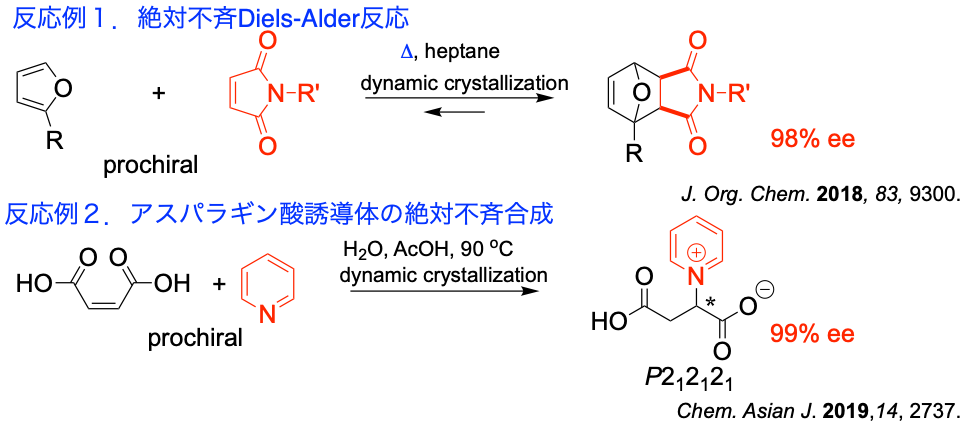
簡便に工業的にも広く応用できる絶対不斉合成法を目指して,プロキラルな化合物から不斉中心を形成する反応と動的結晶化を融合した新しい絶対不斉合成法を開発しています。例えば,反応例1のように,プロキラルなフランとマレイミドを封管中で混合し,生成したDiels-Alder (DA) 付加物の結晶をそのまま懸濁・攪拌を続けるだけで,98% eeの付加体が得られてくる反応を開発しました。この反応では,DA反応により,不斉中心を有する付加体が反応系内に結晶として析出してきます。反応の初期にはラセミ体として生成してきますが, 生成物がコングロメレートを形成する場合には,DA反応が可逆的であるために,徐々にデラセミ化が進行し,数日後には一方のエナンチオマーの結晶に収束します。
次の反応例2では,水中でマレイン酸にピリジンを反応させると,Aza-Michael付加生成物の結晶が析出してきます。この結晶はコングロメレートであり,酢酸を加えてそのまま懸濁攪拌することで,脱プロトン化によるラセミ化を経由した動的結晶化により,99% eeの結晶へと不斉増幅が起こります。この方法は様々な反応系での大量不斉合成へと応用することができます。さらに,光学活性化合物などを全く用いませんので,経済的かつ環境に優しい不斉合成法です。
◆炭素-窒素結合間に軸不斉を持つ不斉配位子の開発
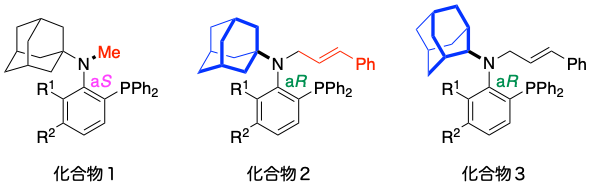
触媒的不斉反応に用いられる遷移金属触媒は,反応活性中心となる金属と不斉場を構築する不斉配位子とから構成されます。金属としてはパラジウム,ロジウム,銅などが利用されますが,同じ金属を用いても不斉配位子の選択により,反応活性だけでなく,得られる生成物の光学純度が大きく変化します。本研究室では,高い収率かつ高い光学収率で生成物を得るための高機能な不斉配位子の開発を目的として研究しています。特に,不斉源として,ほとんど利用されてこなかった炭素-窒素結合間のねじれを利用した不斉配位子を開発しています。これまでに,化合物1のような嵩高い1-アダマンチル基を有するアニリン誘導体が光学活性体として存在し,不斉配位子として有効に作用することを見出しています。また化合物1のメチル基部分をシンナミル基に置換した化合物2は,炭素-窒素結合間が逆向きにねじれた構造を持つにも関わらず,パラジウムを触媒として用いた触媒的不斉反応において化合物1を利用した場合と同じ絶対構造を持つ生成物を与えることを明らかにしました。最近では,より嵩高さが小さい第二級アルキル基である2-アダマンチル基を有する化合物3が光学活性体として存在し,不斉配位子として利用可能であることも明らかにしています。
Org. Biomol. Chem., 2019, 17, 1455.
J. Oleo Sci., 2018, 67, 1189.
Org. Biomol. Chem., 2016, 14, 7509.
◆ヒドラゾン-遷移金属触媒を用いた結合形成反応の開発
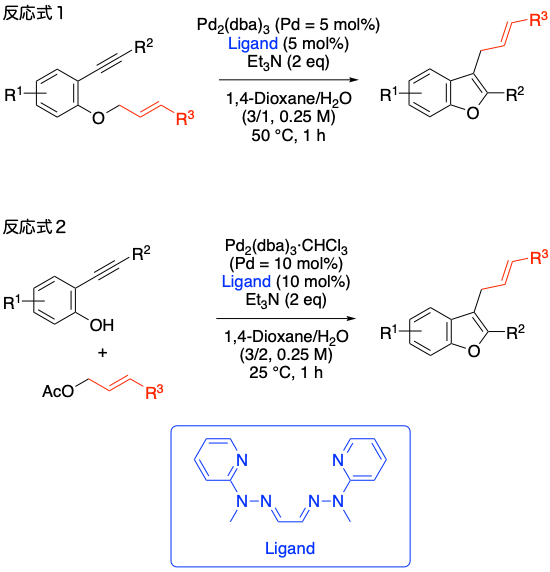
本研究室では,これまでにヒドラゾン化合物がパラジウム触媒によるSuzuki反応やHeck反応の配位子として非常に有効であるということを見出しました。ヒドラゾンは対応するカルボニル化合物とヒドラジンから容易に調製が可能であり,空気中でも安定であるため,遷移金属触媒の配位子として一般的に用いられる有機リン化合物より汎用性が高いと考えられます。現在,ヒドラゾン-遷移金属触媒を用いた新しい結合形成反応の開発に取り組んでいます。例えば最近では,反応式1のような分子内環化を経るベンゾフラン構築反応に,ヒドラゾン-パラジウム触媒が有効に作用することを明らかにしました。また,同様の触媒を利用することで,反応式2のような分子間反応によるベンゾフラン構築にも成功しています。本反応は,反応式1の基質を経ることなくベンゾフランが直接的に構築されることが明らかになっています。
有機合成化学協会誌,2018, 76, 828.
Org. Biomol. Chem., 2018, 16, 575.
Eur. J. Org. Chem., 2017, 2359.
Org. Chem. Front., 2016, 3, 979.
◆有機分子触媒を用いる極性転換反応による新規不斉合成法開発
キラルな化合物は医薬品や香料に広く用いられているものの,エナンチオマー間で生理活性が異なることがあるため,その一方のみを高い純度で合成する不斉合成は重要です。その効率的手法として,近年では,金属を含まない触媒である有機分子触媒による不斉合成が注目されています。有機分子触媒は,比較的安価,低毒性,空気や水に安定であるなどの特徴があり,金属触媒を用いた場合に危惧される生成物の金属汚染も起こりません。私たちは,新規有機分子触媒の開発と,それによって初めて達成される反応の開発を目指しています。
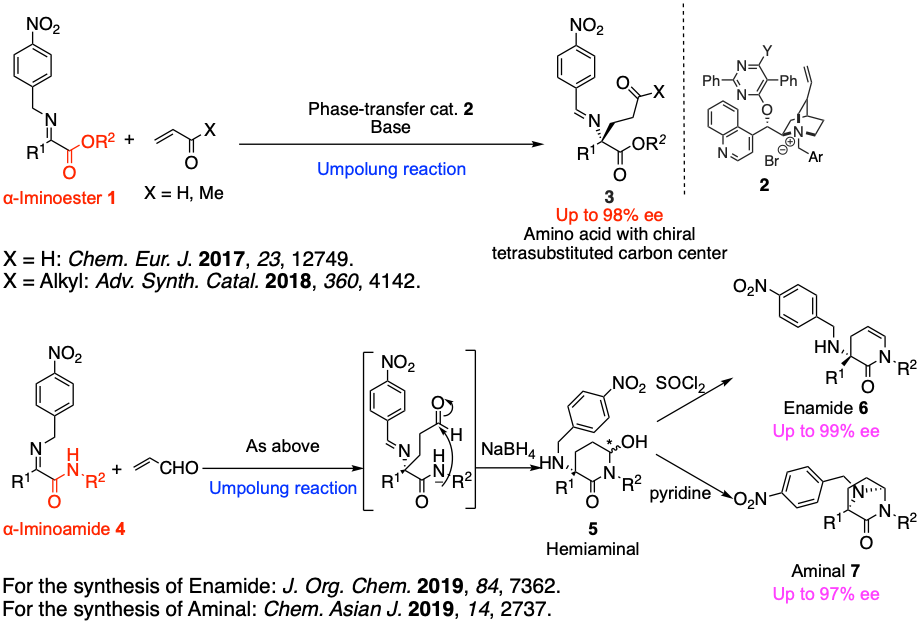
これまでに,反応経路の効率化に有益であるため最近注目されている有機分子触媒を用いる極性転換反応を2を用いて行うことにより,α−イミノエステル1やα−イミノアミド4とα,β−不飽和カルボニル化合物のエナンチオ選択的マイケル付加反応を達成しています。その結果,α−イミノエステルからは非天然アミノ酸3が,α−イミノアミドからは続くカスケード反応も進行したエナミド6とアミナール7が高収率,高い化学,位置およびエナンチオ選択性で得られる事を見出しています。
◆キラル超原子価ハロゲン化合物の開発と応用
ヨウ素原子や臭素原子といったハロゲン原子は,その小さな電気陰性度や大きな原子半径等の特徴から,オクテット則を満たす8個より多くの電子を有する,超原子価状態をとることが可能です。超原子価ヨウ素試薬は,メタルフリーで温和な酸化剤として広く用いられており,キラルな超原子価ヨウ素試薬を用いた不斉酸化反応,およびその有機分子触媒化も近年盛んに研究されています。しかしながら,3価の超原子価ヨウ素試薬を用いた不斉反応は盛んに研究されている一方,5価の超原子価ヨウ素試薬に関する報告は限られています。私たちはこれまでに,5価のキラル超原子価ヨウ素試薬として乳酸由来の10や面不斉を有するクラウンエーテル型の11や12の開発と,その不斉反応への応用を報告しており,現在このキラル試薬を用いた新規不斉反応の開発を行っています。
また近年,超原子価ヨウ素化合物であるヨードニウム塩がハロゲン結合供与体として機能することが明らかとなっており,その有機合成への応用が注目されています。我々は,これまでに触媒としての応用例が無いブロモニウム塩に着目し,そのハロゲン結合を駆動力とする新規不斉反応開発を目指して研究しています。例えば,ブロモニウム塩16はインドール13とエノン14のマイケル付加反応においてハロゲン結合触媒として機能することを明らかにしており,生成物15が最高90%収率で得られることを見出しています。


