Project-1. テルペンの高効率なバイオ合成
テルペン・テルペノイドは、植物や微生物がつくるC5骨格をもつ天然化合物群です。
地球上には100万種を越えるテルペノイドが存在するとも云われています。中には、医薬、農薬、化粧品材料や香料、マテリアル(人工/天然ゴム)、更には、優れたジェット・ディーゼル燃料として注目されるものもあります。私たちの物質文明をここまで多方面に支える代謝物群は他にないでしょう。
[1] テルペン酵素を鍛え直す
世界では,これらテルペン化合物の効率的な生物生産を目指して,欧米を中心とした熾烈な競争が続いています。この分野の発展は目覚ましく,15年前にくらべると,テルペンのバイオ生産効率は10万倍程度まで向上しました。しかしここ数年は,世界中のどの研究室も,生産量を有意に上げることができずに困っています。
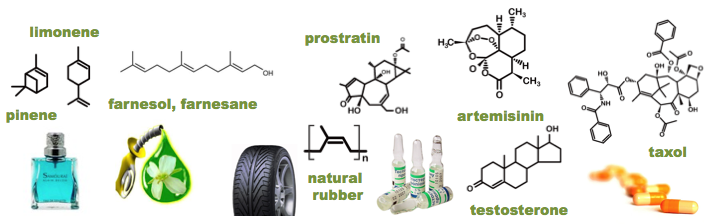
この伸び悩みは,生合成経路をなす酵素ひとつひとつの触媒スペックの不足によるものであると,私たちは考えています(香料,化学と生物)。そして最近、あらゆるテルペン合成酵素の活性を、細胞の中にはいったまま可視化する画期的な手法を開発しました(特開2011-125334 + Plos One, 2014:特許公開)。この手法を用いて、自然界から新しいテルペン酵素の遺伝子を探索する研究、そして、それらの酵素機能を改良する研究をすすめています。
→ ゲラニオール(香料)合成酵素の活性改良(Plos One 2014)
→ ビサボレン(バイオ燃料)合成酵素の活性改良
→ ピネン(香料)合成酵素の活性改良(ACS SynBio, 2016)
私たちの研究結果によれば,やっぱり,酵素の性能があがると,バイオ生産量も上がるみたいです。そう。テルペノイド代謝工学は,蛋白質工学が大きな役割を果たす時代に突入したのです。
[2] 宿主工学
パワフルな酵素や生合成経路は,それをインストールする細胞に大きな負荷を与えます。馬力の高いテルペン生産に耐え得る宿主細胞の開発研究も行っています。私たちは,大腸菌ゲノムの複数の座位を,連続的に,そして並列的に行い得る組換え細胞の選抜技術を完成させました(特開2011-125334 + Plos One, 2015)。目指すは世界標準!テルペン生産のモンスター株の完成を夢見て,私たちは燃えてます!
[3] 新規触媒能
テルペン合成酵素は,カルボカチオンを経由する独特なロジックでC-C結合を形成する面白い酵素です。この反応メカニズム,とくにこのケミストリーの持つ「進化能」を探る基礎的な研究も行っています。望む「炭素-炭素結合」を自在に、そして一段階で創る(それも常温常圧で環境に優しく)!自然界の作り出した驚くべき有機化学スキームを精密に解明し、それを自在に利用することが最終的な目標です。
→ ゲラニルファルネシル合成酵素の進化工学(Nat Commun 2015)
→ カロテノイドを創るスクアレン酵素(FEBS Letters, 2015)
関連リンク
- 池内昌彦研究室(東京大学総合文化)
- 邊見 久研究室(名古屋大学)
- 星野力・佐藤研究室(新潟大学農学部)
- 阿部郁朗研究室(東京大学薬学部)
- 飯島陽子研究室(神奈川工科大学)
- 渡辺 智研究室(東京農大)
- Genecor/DuPont
- イソプレノイド研究会
- TerpNET
Project-2. カロテノイド色素のバイオ生産
カロテノイドは、植物や微生物がつくる天然色素の一群です。優れた抗酸化能、抗腫瘍・免疫賦活力などを持つものも多く、βカロテン、リコペン、アスタキサンチンなど、化粧品原料や食品着色料、健康食品や医薬成分として広く使われています。
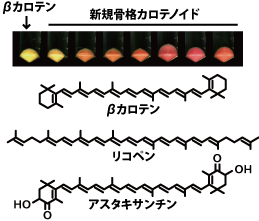
[1] 非天然色素の生物生産へ
私たちは、独自に提唱する「代謝進化工学」という開発プラットフォーム技術を用いて、自然界には存在しない、新規な骨格をもつカロテノイド色素の生合成経路を創ってきました。化粧品・医薬としての新機能を探索すること、そして黄~赤に限定されていたカロテノイド色素の守備範囲を拡張し,「新色」ラインナップを創りだすことが目標です。
[2] 非天然な天然物経路を創る?
1960年代くらいまでは,カロテノイドはスクアレン類(C40骨格を持つスクアレン:リコペルセン)という化合物から生合成されると信じられていましたが,フィトエン合成酵素の発見によって,完全に否定されました。
私たちは,黄色ブドウ球菌の酵素を調べているときに,この忘れ去られた,あるいは「あり得た」はずの生合成経路が構築できることを発見しました(FEBS Lett)。スクアレンの色素化経路の発見は,抗メタボ薬の標的酵素として名高いスクアレン酵素の阻害剤Screeningが可能とする画期的な発見です。
[3] カロテノイド経路を「飼う」?
いっぽう,この原理を利用することによって,スクアレン酵素のカロテノイド酵素への改造(FEBS Lett)やサイズ特異性の改変などが可能となりました。「生合成経路は,どのようにして新しい機能を獲得するのだろう?」これを問うユニークな研究モチーフとして,この人工生合成経路を,多世代に渡って進化・多様化させ続けています。
関連リンク
Project-3. 非天然コレステロールの合成経路
さまざまな高次生命現象に関わるステロイド/コレステロール分子。これらも千に迫る構造多様性があります。そしてこの全てが,C30骨格をもつスクアレンを起点として合成されます。
[1] 非天然コレステロールへの道
私たちは最近,スクアレン合成酵素を実験室内で進化させ,非天然骨格をもつ化合物をつくることに成功しました。これらを更に下流の酵素とくみあわせ,さまざまな新規な生理活性物質の合成に挑んでいます。
[2] 抗メタボ薬を目指して
さまざまなスクアレン合成酵素の変異体を取得してきた私たちは,その解析を通して、スクアレン酵素の反応化学に迫りたいと考えています。スクアレン合成酵素は、コレステロール生合成経路の第一段階を担う酵素であり、この酵素の活性をコントロールできれば、それは副作用の少ない抗メタボ薬となります。ファイザーを筆頭に、名だたる製薬会社がその阻害剤開発にしのぎを削ってきましたが,その抗メタボ薬」は開発されていません。
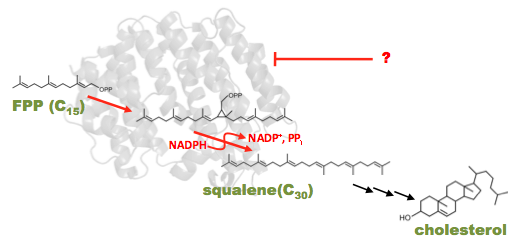
この酵素の作用機序を明らかにし,どのアミノ酸がどのようにこのスクアレンを合成しているかを明らかにすることによって,本酵素の阻害剤探索が飛躍的に容易になると期待されます。
共同研究/おせわになっているところ
- 高市真一 研究室(日本医科大)
- 眞岡孝至 研究室
- 星野 力 研究室(新潟大学)
Project-4. 微生物センサの開発
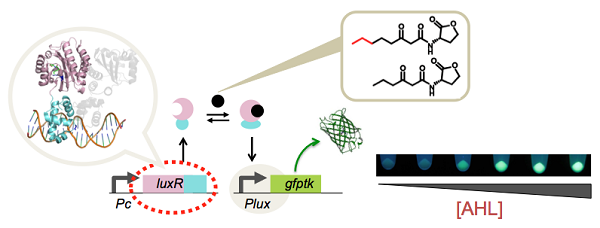
食中毒菌やもみ枯れ菌、MRSAなどの迅速な検出系を開発できれば、病院や食品分析などにおける検査業務を飛躍的に簡略化できます。これらの微生物ひとつひとつを正確かつ高感度に検出するひとつの手段として、かれら微生物の行う化学通信を傍受する方策が有効です。
[1] 奴らの会話を傍受せよ(聞き分けよ)
じつは微生物たちは、特定のフェロモン分子を出し合い化学通信をしています(これをクオラムセンシングといいます)。この通信分子には多様性があるので、特定のフェロモン分子だけを特異的に検出できれば、サンプルの中にある菌の種類や数を迅速に特定できます。
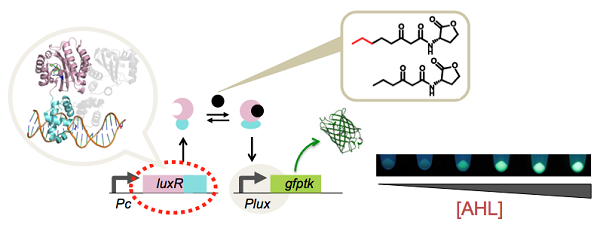
私たちは、グラム陰性菌の授受しているホモセリンラクトン分子に対するセンサタンパク質(LuxRファミリのタンパク質)を改造し、さまざまな種類のホモセリンラクトン分子への特異的なセンサシステムの開発に成功しています(jGAM)。また,これらを使った遺伝子制御回路の構築などにも取り組んでいます(NAR)。
[2] もっと感度を上げよ
私たちは,りな特異性を変えずに検出感度を飛躍的に向上させることにも成功しました(JBB, PLOS ONE)。現在は、それらの変異体の機能向上の分子メカニズムについて詳細な研究を進めると同時に、そもそもセンサという複合動作装置がどのように生まれ,どのように多様化し得るのか,基礎的な研究も継続しています。
[3] 他にもあるぞ,センサ開発
現在,このほかにも,ヒ素センサ,アミノ酸(およびその代謝物)センサ,NADPHセンサ,アセチルコリンセンサ,…などの開発に取り組んでいます。いずれも私たちが世界一と自負している,自動化対応の遺伝子スイッチ超高速進化システム(PLOS ONE)を駆使した開発プロジェクトです。
関連リンク
- Christopher Voigt研究室(UCSF → MIT)
- 横林洋平 研究室(Univ. California, Davis)
Project-5. コリンを使った遺伝子誘導系
コリンは卵黄に豊富に含まれる栄養成分であり,その入手も合成も容易です:つまり,安全安価な化合物です。
コリンで遺伝子を誘導する?
私たちは,大腸菌の浸透圧応答システムの一部,BetI/ BetOシステムを使った,汎用性たかく性能の高い遺伝子誘導系を開発しました(ACS SynBio, ACS SynBio)。
私たちは,この系の更なる高感度化に成功し(すでに感度を2,000倍感度を下げることに成功しています),発酵生産における「遺伝子誘導コスト」の極小化を完成させました。現在は,遺伝子スイッチの緊縮度(誘導しないときの遺伝子発現漏出がないこと)の向上を目指して,蛋白質工学的,合成生物学的な様々な検討を試しています。
※ なお本研究は,協和発酵との共同研究として開始しました。
関連リンク
- 協和発酵バイオ
- Christopher Voigt研究室(UCSF → MIT)
- 横林洋平 研究室(Univ. California, Davis)
Project-6. 微生物ゲノムの高速編集技術
微生物を使ったバイオテクノロジーの鍵となるのが、微生物ゲノムの高速な加工・編集技術です。本当に優れた細胞工場をつくるためには、ゲノム中に散らばる複数の遺伝子を大規模に削除/書き換え/導入する必要があります。そのひとつひとつの作業は,相同組換えを用いたゲノムDNAの書き換え法によって繰り返し行います。この遺伝子組換えの効率を極限まで高め、その操作を自動化できれば、さまざまな特殊能力をもつ微生物を超高速に開発できるようなります。
私たちは最近、法政大学の川岸/曽和研究室とともに、その自動化の鍵となり得る,組換え株の迅速な選択法を開発しました(特許出願:PLOS ONE)。大腸菌の大規模なゲノム工学法の迅速化,標準化を目指しています。
この手法を用いて,私たちは,物質生産により適した大腸菌株の作出に挑んでいます(未発表)。また、この手法を大腸菌に限らず様々なバクテリアのゲノム工学にも応用する研究を行っています。
Link
- 川岸・曽和研究室(法政大学)
- George Church研究室(ハーバード大学)
- 近藤昭彦研究室(神戸大学)
